②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu的原子个数比为
溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是
原子核外电子排布,元素电离能、电负性的含义及应用,配合物的成键情况,晶胞的计算,原子轨道杂化方式及杂化类型判断
(1)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素;同一周期元素的电负性随着原子序数的增大而呈增强;
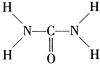
可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;
(3)排斥力:孤对电子-成键电子>成键电子-成键电子,排斥力大,键角被压缩;
(5)Fe(Ⅲ)有空轨道,尿素分子中N原子含有孤对电子,二者形成配位键;根据化学式中化合价的代数和为零来书写化学式;根据物理性质来判断晶体类型;氧与硫的最外层电子数相同,先确定SCN-中各原子的连接顺序以及成键方式,再结合离子电子式的书写方法书写.解答:解:(1)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能由大到小的顺序为:N>O>C;同一周期元素的电负性随着原子序数的增大而呈增强,所以电负性由大到小的顺序为:O>N>C;

可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp
(3)NH3中N原子含有1对孤对电子,NH+4中N原子没有孤对电子,NH+4中N-H键之间的排斥力较小,故NH+4中H-N-H键角大,
故答案为:NH3中N原子含有1对孤对电子,NH+4中N原子没有孤对电子,NH+4中N-H键之间的排斥力较小;
(4)①以顶点的二氧化碳分子研究,与之最近的二氧化碳分子位于面心上,将晶胞补全可知,有3层每各有4个二氧化米乐M6 米乐平台碳分子与之最近,故之最近的二氧化碳分子有4×3=12,
(5)Fe(Ⅲ)有空轨道,尿素分子中N原子含有孤对电子,二者形成配位键;FeCl溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是K中各原子的连接顺序为S-C-N,S与C形成一对共用电子对,C与N形成三对共用电子对,SCN
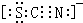
(2)质量分数为36.5%的盐酸(密度为1.19g?cm-3),该溶液的物质的量浓度为mol/L.
(3)标准状况下5.6LNH3的质量约为g;将该5.6LNH3溶于100mL水中,所得氨水的密度为ρg?cm-3,则该氨水中氨的物质的量浓度的计算式是mol/L(只要求列出计算式).
(2)降低温度,该反应K值,二氧化硫转化率(以上均填“增大”、“减小”或“不变”).
Ⅰ、(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:.
若1molNH3还原NO至N2,则该反应过程中的反应热△H3=kJ/mol(用含a、b的式子表示).
Ⅱ.氨的合成是最重要的化工生产之一.已知:N2+3H2?2NH3,在3个体积均为2L的密闭容器中,在相同的温度下,使用相同的催化剂合成氨,实验测得反应在起始、达到平衡时的有关数据如表所示:
Ⅲ.直接供氨式碱性燃料电池的电池反应式是4NH3+3O2═2N2+6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是.
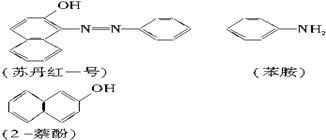
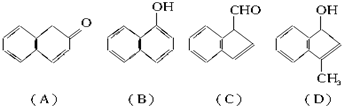
(2)在下面化合物(A)~(D)中,与2-萘酚互为同分异构体的有(填字母代号).
(3)在适当的条件下,2-萘酚米乐M6 米乐平台经反应可得到芳香化合物E(C8H6O4),1molE与足量的碳酸氢钠反应可放出44.8LCO2(标准状况),E的结构简式为.
(4)若将E与足量乙醇在浓硫酸作用下加热,可以生成一个化学式(分子式)为C12H14O4的新化合物,该反应的化学方程式是,反应类型是.

