: 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H
(1)基态Fe3+的核外电子排布式为;C、N、O三种元素的第一电离能由大到小的顺序是。
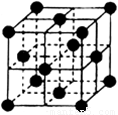
(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如右图所示。
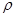
(4)NH3中N原子上有1对孤对电子,NH+4中N原子上没有孤对电子,排斥力较小(1分)
试题分析:(1)Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5。同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半满稳定状态,能量降低,失去电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能N>O>C。
(2)由尿素的结构式可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,因此N原子采取sp3杂化。
(3)NH3中N原子上含有1对孤对电子,NH+4中N原子上没有孤对电子,因此NH+4中N-H键之间的排斥力较小,故NH+4中H-N-H键角大。
(4)①以顶点米乐M6 m6米乐的二氧化碳分子为中心,与之最近的二氧化碳分子位于面心上。则每个晶胞中含有3个CO2分子。由于每个顶点可以形成8个相同的立方体,其中每个面被2个立方体共用,所以与之最近的二氧化碳分子有(8×3)÷2=12。
②若顶点、面心为钠离子,则体心、棱中心为氯离子,则晶胞中含有米乐M6 m6米乐的钠离子数目为8×
考点:考查核外电子排布规律、杂化轨道理论、第一电离能比较、价层电子对互斥理论、晶胞结构与晶胞体积的计算等
(3)NH+4中H-N-H键角比NH3中H-N-H键角大,原因为NH3中N原子含有1对孤对电子,NH+4中N原子没有孤对电子,NH+4中N-H键之间的排斥力较小NH3中N原子含有1对孤对电子,NH+4中N原子没有孤对电子,NH+4中N-H键之间的排斥力较小.
(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如图所示.
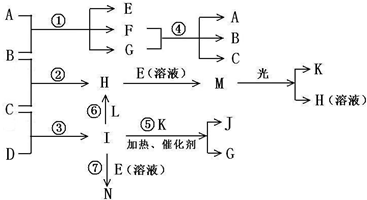
(3)E(溶液)能与I以1:2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,写出N的结构式
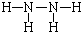
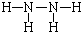
(4)L是由3种元素构成的分子,能与I以1:2的物质的量之比反应生成尿素CO(NH
(5)常温下,实验室模拟工业反应④的过程如图所示,标况下,当电极上产生112mL(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=1313.(假设气体完全逸出,溶液体积不变)
(2)若合成氨反应容器的容积为2L,开始充入3molH2和1molN2反应达到平衡时气体的压强变为原来的78,则氮气的转化率为.该反应的化学平衡常数的表达式为,升高温度,平衡常数将.(填增大、减少或不变);增大反应容器的体积,再达到平衡时,混合气的平均分子量将.(填增大、减少或不变).
(3)在一定条件下氨可与其他物质反应生成尿素〔CO(NH2)2〕,已知30g尿素在高温高压下分解生成11.2LNH3(标况)、5.6LCO2和一定量的三聚氰胺分子(三聚氰胺的相对分子质量为126).不法分子曾在低蛋白含量的奶粉中加入三聚氰胺来提高奶粉中的蛋白质含量,导致许多婴幼儿肾结石.写出三聚氰胺的分子式为,其化学反应方程式为.三聚氰胺分子中有m6米乐官网 米乐M6平台入口一个六元环,一个三聚氰胺分子可分解生成三个分子A,则A的结构式是.
H2NCONH2·H2O2,不但使H2O2稳定下来,而且其结构也没有发生改变,得到了可供衍射实验的单晶体。已知H2O2的结构式为H-O-O-H,下列说法中不正确的是[ ]A. H2NCONH2与H2O2是通过氢键结合的

