常温下呈液态,熔点为-20.5℃,沸点为m6米乐官网 米乐M6平台入口103℃,易溶于非极性溶剂,据此可判断Fe(CO)的中心原子价电子数与配体提供电子数之和为18,则x=5.Fe(CO)在一定条件下发生反应:Fe(CO)(s)═Fe(s)+xCO(g),已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有金属键.
分析(1)Fe原子核外电子数为26,原子形成阳离子先按能层高低失去电子,能层越高的电子越容易失去,同一能层中按能级高低失去电子,能级越高越容易失去;同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半满稳定状态,能量降低,失去电子需要的能量较高,第一电离能高于同周期相邻元素;
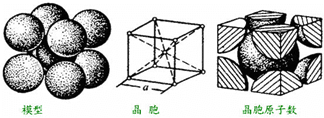
(3)分子晶体的熔沸点较低;配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,据此判断x值;根据生成物判断形成的化学键;
解答解:(1)Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5,同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半满稳定状态,能量降低,失去电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能N>O>C,
(2)尿素分子中N原子的价层电子对数为$\frac{5+3}{2}$=4,所以N原子的杂化方式为sp3,NO3-中N原子的价层电子对数为$\frac{5+1}{2}$=3,氮原子没有孤电子对,所以NO3-空间构型是平面三角形,
(3)分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体,配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5,Fe(CO)5在一定条件下发生分米乐M6 米乐平台解反应:Fe(CO)5=Fe(s)+5CO,反应生成Fe,所以形成的化学键为金属键,
点评本题考查核外电子排布规律、杂化轨道理论、络合物、晶胞计算等,难度中等,注意等电子体为原子总数相等,核外电子总数或价电子总数相等的微粒
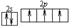
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B原子的结构示意图为
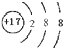
(3)D元素的正三价离子的3d轨道为半充满,D中有26种不同运动状态的电子,其基态原子的电子排布式为[Ar]3d
64s2(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为Cu,在元素周期表中处于4周期ⅠB族,
2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率0.05mol/(Lmin).(2)假设该反应是在恒容条件下进行,判断该反应达到平衡的标志AD.
2同时生成1molO2B.混合气体密度不变C.混合气体平均相对分子质量不变D.2v(N2)正=v(NO)逆(3)将N
2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是AC(填字母序号).
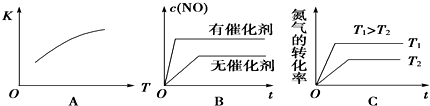
2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态.与原平衡状态相比,此时平衡混合气中NO的体积分数不变.(填“变大”、“变小”或“不变”)(5)该温度下,某时刻测得容器内N
2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应向正反应方向进行(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是因为浓度商Qc<K.

